RFBR 19-34-90118, RFBR 18-04-00924
RFBR 19-34-90118:
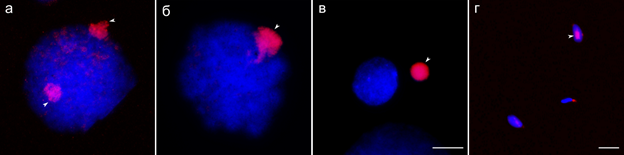
Для анализа поведения GRC на разных стадиях сперматогенеза у большой синицы мы использовали антитела к триметилированному гистону H3 по девятому остатку лизина (H3K9me3). Ранее было показано, что начиная с профазы мейоза I на GRC выявляется сильный сигнал H3K9me3, который сохраняется даже после элиминации GRC из ядра (del Priore & Pigozzi, 2014). H3K9me3 обычно выявляется в бедных генами районах хроматина, таких как теломеры и перицентромерные области (Mikkelsen et al., 2007; Pauler et al., 2009).
Окрашивание антителами к H3K9me3 препаратов распластанных ядер самцов большой синицы показало наличие сигнала почти во всех клетках. Мейтические клетки всегда содержали как минимум один сильный сигнал H3K9me3 (Рис. 1б). В некоторых клетках мы обнаружили два таких сигнала: один – в центре ядре и другой – на периферии (Рис. 1а). В сперматидах и сперматозоидах сигнал H3K9me3, как правило, отсутствовал (Рис. 1в). В 3 из 880 рассмотренных сперматозоидов (0.0035%) мы детектировали сигнал H3K9me3 внутри ядра (Рис. 1г). Детекция сперматозоидов большой синицы с сигналом H3K9me3 подтверждает сделанный ранее вывод о возможном наследовании GRC по отцовской линии у зебровой амадины (Pei et al., 2021). Pei c соавторами c помощью FISH с GRC-специфичными зондами и конфокальной микроскопии показали, что у зебровой амадины от 1 до 19% сперматозоидов содержат GRC.
Таким образом, мы впервые обнаружили мозаицизм по числу копий GRC в мужских половых клетках у большой синицы. Мы предполагаем, что поведение GRC в сперматогенезе у большой синицы схоже с таковым у бледной ласточки и согласуется с предложенным нами ранее сценарием наследования GRC. Мы показали, что у большой синицы некоторые сперматозоиды содержат GRC. Это свидетельствует о возможности наследственной передачи GRC не только от матери, как считалось ранее, но и от отца.
RFBR 18-04-00924:
We have shown that the germ-line restricted chromosome (GRC) is apparently present in all songbirds. Using immunostaining of meiotic chromosome spreads, GRC was found in 12 species from the suborder songbirds. Together with the previously studied species, GRC was described in 16 bird species, which are representatives of eight families of this suborder. No species with GRC were found outside this suborder.
We have shown that GRCs of different species differ in size and genetic content. Fluorescent in situ hybridization (FISH) with microdissection GRC-specific probes showed that GRCs of closely related species retain a high degree of homology, while GRCs of phylogenetically distant species lose it. Different GRC probes specifically labeled different regions of the basic chromosome set. Analysis of the sequencing results of the GRC microdissection DNA libraries confirmed that GRC contain multiple repeated sequences homologous to the main genome, different in different species. We also identified sequences that are present in the GRC of all five species.
Thus, GRC probably evolved in the common ancestor of passerine songbirds about 35 million years ago and underwent significant changes in the course of independent evolution in different lineages. Based on the data obtained, we proposed a scenario of the GRC occurrence in the common ancestor of songbirds by duplication of one of the microchromosomes.
We revealed mosaicism by the GRC copy number in females of the great tit (Parus major) and monomorphism in males. FISH with microdissection GRC-specific probe of great tit showed intense labelling of most microchromosomes. We proposed a scenario of the GRC transmission in a series of generations, based on the assumption of regular nondisjunction and meiotic drive of GRC in the female germ line.
To obtain GRC-specific sequences in great tit we sequenced embryonic and somatic tissues using the long-read method. Using subtractive comparison of the germline and somatic genome sequencing data, we identified 177 genes, the variants of which are specific for the great tit GRC. Only 4 of them were previously found in zebra finch GRC.